Lo smog fotochimico
Idrocarburi ed ossidi d’azoto prodotti dal traffico e da alcune attività
industriali possono subire trasformazioni attraverso reazioni di
fotoossidazione in fase gassosa, con sviluppo di ozono ed altri
ossidanti fotochimici. Si sviluppa così quel tipo d’inquinamento
atmosferico noto come smog fotochimico.
L’andamento giornaliero della concentrazione dell’ozono è normalmente
usato come tracciante degli ossidanti fotochimici. Lo sviluppo
dell’ozono è dovuto alla fotolisi del biossido d’azoto, per azione dei
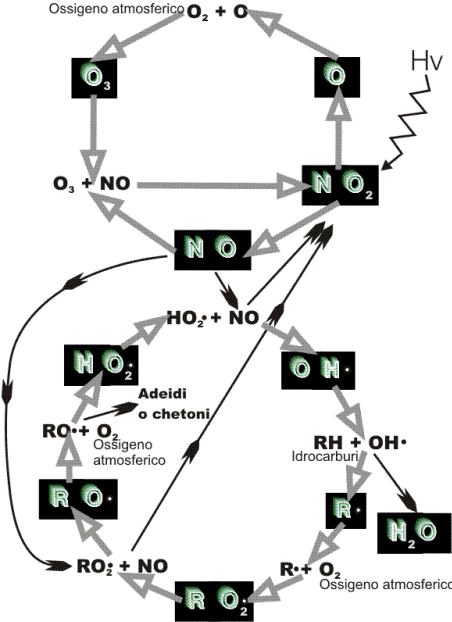
raggi ultravioletti, attraverso le reazioni:
NO2 ![]() NO
+ O
O + O2
NO
+ O
O + O2 ![]() O3
O3 + NO
O3
O3 + NO ![]() NO2
+ O2
NO2
+ O2
Queste reazioni costituiscono il ciclo fotolitico degli ossidi d’azoto,
per il quale si può esprimere uno stato di equilibrio fotostazionario.
L’intero ciclo non conduce ad alcuna produzione di ossidante, dal
 momento che
per ogni molecola di NO2 prodotta viene rimossa una molecola di O3. Ogni
altra reazione diversa dalle precedenti che trasformi l’NO in NO2,
comporta la produzione netta di una molecola di O3. Ad esempio, durante
l’ossidazione degli idrocarburi la riconversione dell’NO in NO2 può
essere effettuata dai radicali perossidici prodotti in seguito
all’iniziale attacco dei radicali OH• sugli idrocarburi:
momento che
per ogni molecola di NO2 prodotta viene rimossa una molecola di O3. Ogni
altra reazione diversa dalle precedenti che trasformi l’NO in NO2,
comporta la produzione netta di una molecola di O3. Ad esempio, durante
l’ossidazione degli idrocarburi la riconversione dell’NO in NO2 può
essere effettuata dai radicali perossidici prodotti in seguito
all’iniziale attacco dei radicali OH• sugli idrocarburi:
OH• + RH• ![]() H2O + R•
H2O + R•
R + O2 ![]() RO2•
RO2•
RO2• + NO![]() RO•
+ NO2
RO•
+ NO2
La velocità di reazione fra un idrocarburo ed il radicale OH• viene
utilizzata per definire una scala di reattività degli idrocarburi.
La capacità di un idrocarburo di produrre ozono dipende dalla velocità e
dall’efficacia di produzione del radicale perossidico RO2•, il quale a
sua volta ossida l’NO ad NO2. Inoltre, dalla produzione del radicale
RO2• e dalla conseguente reazione possono svilupparsi altre reazioni
regolate dal radicale RO•. Infatti RO• può reagire con l’ossigeno: RO• +
O2 ![]() HO2• + aldeidi o chetoni
HO2• + aldeidi o chetoni
mentre OH• viene rigenerato dalla reazione:
HO2• + NO![]() NO2 + OH•
NO2 + OH•
In quest’ultima reazione si trasforma anche una seconda molecola di NO
in NO2 e conseguentemente viene prodotta un’altra molecola di O3. È così
evidente che la reattività di un determinato composto organico è una
funzione del numero di conversioni delle molecole di NO in NO2 che
avvengono durante il suo processo d’ossidazione. Anche composti
contenenti gruppi carbonilici (p.es. aldeidi e chetoni) giocano un ruolo
importante perché sono sottoposti ad una fotodissociazione diretta e
perciò costituiscono fonte di radicali liberi, come ad esempio per
l’acetone: CH3COCH3![]() CH3• + CH3CO•
CH3• + CH3CO•
Il radicale acetilico CH3CO• può anche essere prodotto dalla reazione
dell’OH• con acetaldeide: CH3CHO + OH•![]() CH3CO• + H2O
CH3CO• + H2O
Inoltre, il radicale acetilico è considerato il precursore nella
formazione del nitrato di perossiacetile (PAN), come è indicato nelle
seguenti reazioni a catena:
CH3CO• + O2![]() CH3COO2• (radicale perossiacetilico) CH3COO2• + NO2
CH3COO2• (radicale perossiacetilico) CH3COO2• + NO2![]() CH3COO2NO2 (PAN)
CH3COO2NO2 (PAN)
Il PAN è uno dei più importanti prodotti ossidanti dello smog
fotochimico. Com’è anche indicato nell’ultima reazione, la formazione
del PAN è reversibile ed è legata alla produzione del radicale CH3CO•
durante l’ossidazione di composti organici specifici. Il radicale perossiacetilico CH3COO2•, in alternativa alla produzione di PAN, può
essere coinvolto in una reazione con NO:
CH3COO2• + NO![]() CH3• + NO2 + CO2
CH3• + NO2 + CO2
Il radicale metilico CH3• può reagire con O2 per dare CH3O2•, che a sua
volta può essere ossidato in aldeide formica HCHO con ulteriore
ossidazione di NO in NO2 e produzione di OH• :
CH3• + O2![]() CH302• CH302• + NO
CH302• CH302• + NO![]() CH3O• + NO2 CH3O• + O2
CH3O• + NO2 CH3O• + O2![]() HCHO + HO2• HO2• +
NO
HCHO + HO2• HO2• +
NO![]() OH• + NO2
OH• + NO2
Nelle reazioni a catena dei processi di fotoossidazione le
concentrazioni dei radicali dipendono dall’equilibrio tra le reazioni di
produzione (normali e fotochimiche) di composti secondari e quelle di
rimozione, alcune delle quali anche di tipo eterogeneo. Un’importante
reazione di rimozione è quella che avviene fra l’OH• e l’NO2 per dare
acido nitrico: OH• + NO2![]() HNO3
HNO3
L'acido nitrico, che è altamente solubile, può essere rimosso attraverso
diversi processi eterogenei, come la solubilizzazione nella pioggia,
l’attacco ad aerosol o particelle sospese, la deposizione secca su
superfici. L’acido nitrico può anche essere rimosso per reazione con
l’ammoniaca, sempre presente in atmosfera, per formare nitrato d’ammonio
che può condensare in aerosol.
Negli aerosol provenienti da aree industriali od urbane, di norma, i
solfati sono più abbondanti dei nitrati e contribuiscono
apprezzabilmente alla riduzione della visibilità in atmosfere inquinate.
Infatti l’SO2 può essere ossidato in solfato sia in modo omogeneo nella
fase gassosa, sia in modo eterogeneo nelle micro-gocce sospese in
atmosfera. La prevalenza di uno dei due processi ossidativi è
determinata da fattori climatici.
Un altro importante processo di rimozione in atmosfera per alcune specie
organiche come le olefine, è la reazione con l’ozono. Infatti, in masse
d’aria “invecchiate”, dove gli inquinanti fotochimici hanno già subito
processi di trasformazione, la reazione con l'ozono può essere il
processo di rimozione dominante per le olefine. Sebbene la reazione in
fase gassosa fra ozono e olefine sia conosciuta già da molti anni, la
cinetica ed il meccanismo di questo complesso processo non sono ancora
completamente noti. È stato suggerito che la reazione ozono-olefine
possa essere una sorgente termica di radicali liberi in atmosfera.
I risultati sopra descritti mostrano che diverse classi di composti
organici non solo hanno velocità di reazione notevolmente differenti per
le reazioni con il radicale OH•, ma mostrano anche efficienze differenti
sia per l’ossidazione di catene di radicali, sia per la conversione di
NO in NO2. Quando si fa una valutazione dell’importanza di una data
specie organica nella formazione d’ozono in atmosfere ricche
d’inquinanti primari, debbono essere presi in considerazione entrambi
questi fattori.
La differenza nel comportamento delle varie classi di composti organici,
impone precauzioni nell’uso di modelli a “parametro unificato” (in altre
parole di modelli che contengono un singolo idrocarburo per ciascuna
classe di reattività, o per ciascun raggruppamento d’idrocarburi),
utilizzati per simulare la produzione d’ossidanti in atmosfera, o per
fornire una base a strategie di prevenzione e controllo.
In aria libera si possono ipotizzare un gran numero di reazioni per ogni
singola specie. I modelli a parametro unificato utilizzano alcune specie
“simulate”, prese come traccianti, che sono rappresentative delle
differenti classi di composti organici comunemente riscontrate nelle
atmosfere urbane e/o industriali.
